Des scientifiques identifient des différences essentielles dans le fonctionnement interne des cellules immunitaires
En bref
- Les cellules T cytotoxiques sont un élément important du système immunitaire. Une fois activées, elles se différencient en cellules effectrices à courte durée de vie ou en cellules mémoires à longue durée de vie.
- Des études menées par des scientifiques de l'ETH Zurich ont révélé que l'architecture cellulaire des cellules T influence la fonction que les cellules adoptent lorsqu'elles sont activées par un agent pathogène.
- En plus d'améliorer notre compréhension du système immunitaire, ces résultats pourraient également conduire à de meilleures thérapies contre le cancer.
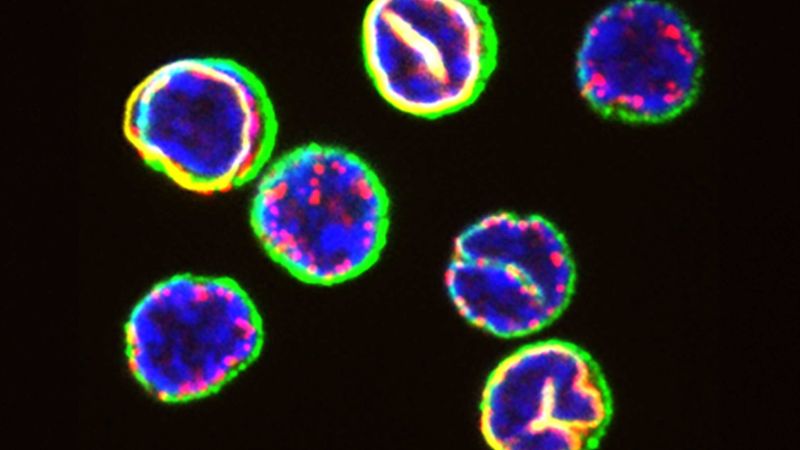
De l'extérieur, la plupart des cellules T se ressemblent : elles sont petites et sphériques. Aujourd'hui, une équipe de recherche dirigée par Berend Snijder de l'Institut de biologie des systèmes moléculaires de l'ETH Zurich a examiné de plus près l'intérieur de ces cellules à l'aide de techniques avancées. Leurs résultats montrent que l'organisation spatiale subcellulaire des cellules T cytotoxiques - que Berend Snijder appelle leur architecture cellulaire - a une influence majeure sur leur destin.
Caractéristiques qui déterminent le destin d'une cellule
Lorsque les cellules à invagination nucléaire rencontrent un agent pathogène, elles se transforment en puissantes cellules effectrices qui prolifèrent rapidement et tuent l'agent pathogène. Leurs congénères à noyau sphérique - c'est-à-dire sans invagination nucléaire - évoluent à un rythme plus lent : elles mettent plus de temps à s'activer et finissent par se différencier en cellules mémoires à longue durée de vie qui défendent l'organisme contre les attaques futures du même agent pathogène.
Les scientifiques ont identifié ces deux populations de cellules T fonctionnellement distinctes il y a une cinquantaine d'années. «Mais jusqu'à présent, nous ne savions pas exactement quelles caractéristiques déterminaient si un lymphocyte T allait devenir une cellule effectrice ou une cellule mémoire», explique Ben Hale, postdoc dans le groupe de recherche de Berend Snijder et auteur principal de l'article récemment publié dans la revue Science.
Pour aider à identifier ces caractéristiques, les scientifiques ont développé une plateforme qui analyse automatiquement les images microscopiques des cellules immunitaires. Ils et elles ont ensuite présenté cette plateforme avec des milliers de cellules T provenant de 24 volontaires en bonne santé qui ont donné leur sang au Service de don de sang de Zurich de la Croix-Rouge suisse.
Différences inattendues
À l'aide d'une approche d'apprentissage automatique, la plateforme a classé les cellules en trois groupes différents. «Nous avions déjà constaté que certains lymphocytes T avaient la forme d'une bouteille lorsqu'ils étaient activés», explique Berend Snijder. «Mais nous ne nous attendions pas à ce que la plateforme divise les cellules rondes en deux groupes différents.»
En approfondissant leurs recherches, les chercheurs et chercheuses ont également découvert que les différences d'architecture cellulaire entre les deux classes de cellules rondes ont également une signification fonctionnelle. «Les cellules présentant des invaginations nucléaires sont conçues pour s'activer rapidement : nombre d'entre elles se transforment en cellules effectrices en forme de bouteille dans les 24 heures», explique Ben Hale.
«Elles organisent également une réponse plus forte lorsqu'elles sont activées et prolifèrent beaucoup plus rapidement que les cellules sans invagination nucléaire», ajoute Berend Snijder. Avec son équipe, il a également identifié le mécanisme moléculaire qui conduit à l'activation plus rapide et plus forte des cellules avec invaginations nucléaires : «Leur architecture cellulaire spéciale permet un afflux accru d'ions calcium», explique-t-il.
Les deux chercheurs soulignent qu'il reste encore de nombreuses questions à résoudre. Par exemple, Berend Snijder et son équipe espèrent maintenant découvrir comment l'organisme fait en sorte qu'environ 60% des cellules T cytotoxiques dans le sang aient des invaginations nucléaires, tandis que 35% n'en ont pas et que les 5% restants ont la forme d'une bouteille.
Rendre les thérapies plus efficaces sur le plan clinique
Berend Snijder et Ben Hale soulignent que leurs résultats ne sont pas seulement «importants pour mieux comprendre le fonctionnement de nos cellules immunitaires», mais qu'ils jouent également un rôle crucial dans la lutte contre le cancer, par exemple : «De nombreuses nouvelles thérapies utilisent les cellules T pour tuer les cellules cancéreuses», explique Berend Snijder. «Si nous pouvons trouver un moyen de sélectionner et de déployer spécifiquement ces architectures cellulaires, nous pourrons peut-être améliorer l'efficacité clinique de ces thérapies.»