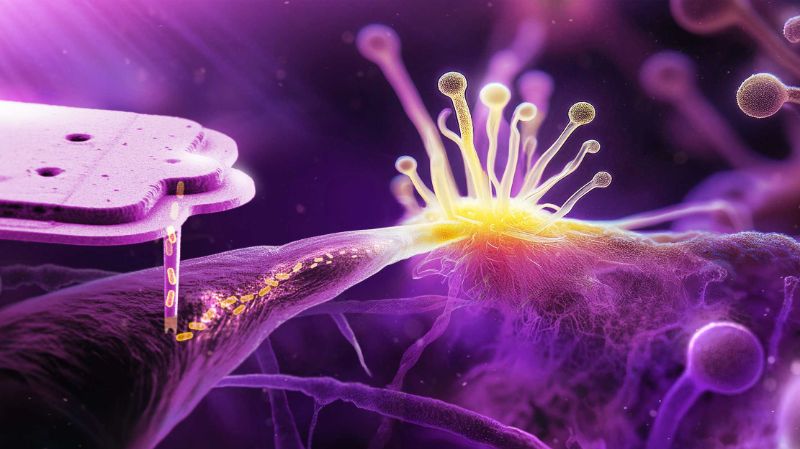
Comment une bactérie devient résidente permanente d'un champignon
En bref
- Un groupe de recherche de l'ETH Zurich a étudié les débuts de l'endosymbiose, la coexistence stable d'une bactérie dans un champignon. Pour ce faire, des bactéries ont été injectées dans les cellules d'un champignon.
- Les scientidfiques ont observé que les bactéries implantées pouvaient à la fois se multiplier dans les cellules de l'hôte et être transmises à la génération suivante.
- Les partenaires cohabitant se sont adaptés l'un à l'autre et ont fini par en bénéficier tous les deux.
L'endosymbiose est un phénomène biologique fascinant dans lequel un organisme vit à l'intérieur d'un autre. Cette relation inhabituelle est souvent bénéfique pour les deux parties. Même dans notre corps, nous trouvons des vestiges de cette cohabitation : les mitochondries, les centrales de nos cellules, sont issues d'une ancienne endosymbiose. Il y a longtemps, des bactéries ont pénétré dans d'autres cellules et y sont restées. Cette coexistence a jeté les bases des mitochondries et donc des cellules des plantes, des animaux et des champignons.
Ce qui est encore mal compris, cependant, c'est la manière dont l'endosymbiose en tant que mode de vie se produit réellement. Une bactérie qui se retrouve plus ou moins accidentellement dans une cellule hôte complètement différente n'a généralement pas la vie facile. Elle doit survivre, se multiplier et être transmise à la génération suivante. Sinon, elle meurt. Et pour ne pas nuire à l'hôte, elle ne doit pas réclamer trop de nutriments pour elle-même ni croître trop rapidement. En d'autres termes, si l'hôte et son résident ne peuvent s'entendre, la relation prend fin.
Pour étudier les débuts d'une relation aussi particulière entre deux organismes, une équipe de recherche dirigée par Julia Vorholt, professeure de microbiologie à l'ETH Zurich, a mis en place de tels partenariats en laboratoire. Les scientifiques ont observé ce qui se passe exactement au début d'une éventuelle endosymbiose. Ils et elles viennent de publier leur étude dans la revue scientifique Nature.
Application de la cohabitation
Pour ce travail, Gabriel Giger, doctorant dans le laboratoire de Julia Vorholt, a d'abord développé une méthode pour injecter des bactéries dans les cellules du champignon Rhizopus microsporus sans les détruire. Il a utilisé des bactéries E. coli d'une part et des bactéries du genre Mycetohabitans d'autre part. Ces dernières sont des endosymbiontes naturels d'un autre champignon Rhizopus. Pour l'expérience, les chercheuses et chercheurs ont toutefois utilisé une souche qui ne forme pas d'endosymbiose dans la nature. Gabriel Giger a ensuite observé au microscope ce qu'il advenait de cette cohabitation forcée.
Après l'injection de la bactérie E. coli, tant le champignon que la bactérie ont continué à croître, cette dernière si rapidement que le champignon a mis en place une réponse immunitaire contre la bactérie. Le champignon s'est protégé des bactéries en les encapsulant. Cela a empêché la transmission de la bactérie à la génération suivante de champignons.
Les bactéries pénètrent dans les spores
Ce n'est pas le cas des bactéries Mycetohabitans injectées : Pendant que le champignon formait des spores, une partie de la bactérie a réussi à s'y introduire et a donc été transmise à la génération suivante. «Le fait que les bactéries soient effectivement transmises à la génération suivante de champignons par l'intermédiaire des spores a constitué une percée dans notre recherche», déclare Gabriel Giger.
Lorsque le doctorant a laissé germer les spores contenant les bactéries résidentes, il a constaté qu'elles germaient moins souvent et que les jeunes champignons se développaient plus lentement qu'en l'absence de ces bactéries. «L'endosymbiose a d'abord réduit l'aptitude générale des champignons concernés», explique-t-il. Gabriel Giger a poursuivi l'expérience sur plusieurs générations de champignons, en sélectionnant délibérément ceux dont les spores contenaient des bactéries. Cela a permis au champignon de se rétablir et de produire davantage de spores habitées mais viables. Comme les scientifiques ont pu le montrer à l'aide d'analyses génétiques, le champignon a changé au cours de cette expérience et s'est adapté à son résident.
Les chercheurs et chercheuses ont également constaté que le résident produisait, avec son hôte, des molécules biologiquement actives qui pouvaient aider l'hôte à obtenir des nutriments et à se défendre contre des prédateurs tels que des nématodes ou des amibes. «Le désavantage initial peut ainsi devenir un avantage», souligne Julia Vorholt.
Systèmes fragiles
Dans leur étude, les scientifiques montrent la fragilité des premiers systèmes endosymbiotiques. «Le fait que la condition physique de l'hôte diminue initialement pourrait signifier la disparition précoce d'un tel système dans des conditions naturelles», explique Gabriel Giger. «Pour que de nouvelles endosymbioses apparaissent et se stabilisent, il faut qu'il y ait un avantage à vivre ensemble», explique Julia Vorholt. La condition préalable est que le futur résident apporte avec lui des propriétés qui favorisent l'endosymbiose. Pour l'hôte, c'est l'occasion d'acquérir d'un seul coup de nouvelles caractéristiques en intégrant un autre organisme, même si cela nécessite des adaptations. «Dans l'évolution, les endosymbioses ont montré le succès qu'elles peuvent finalement rencontrer», souligne la professeure de l'ETH Zurich.