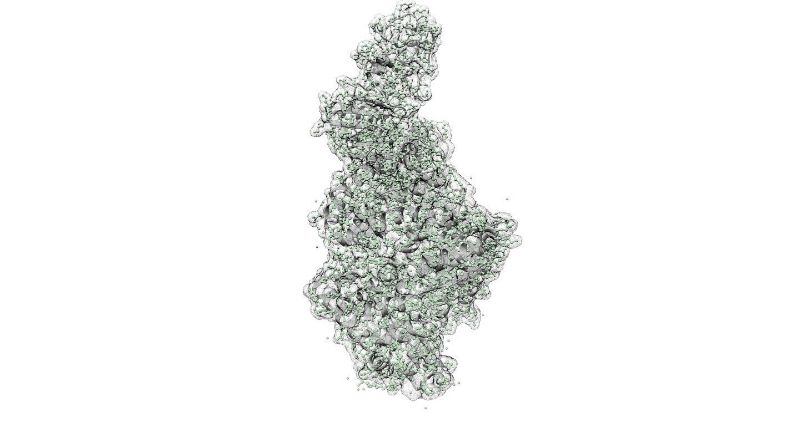
La protéine qui a révolutionné le séquençage de l'ADN
Elle s’appelle Thermus aquaticus, on peut la croiser dans les sources d’eau chaude du Parc national de Yellowstone, aux États-Unis, et elle est capable de résister à des températures atteignant les 80 degrés Celsius. Cette bactérie est un extrêmophile. Elle fait partie d’un groupe d’organismes très divers, capables de survivre à des conditions extrêmes : des environnements très chauds donc, ou alors très froids, très salés, très acides, soumis à une forte pression ou à des radiations ionisantes.
«Les extrêmophiles ont développé de multiples stratégies pour survivre et prospérer dans ces environnements hostiles», indique Ianina Altshuler, professeure assistante tenure track au Laboratoire d’adaptation du microbiome à l’environnement changeant de l’EPFL (MACE). Le laboratoire étudie notamment les micro-organismes vivant dans des cryoenvironnements, pour comprendre leurs mécanismes d’adaptation au froid. «Nombre d’entre eux sont basés sur la production de protéines spécifiques à ces conditions, par exemple des enzymes dont les températures optimales d’activité sont plus basses.»
Des stars de l’extrême aux multiples stratégies
Les supercapacités de ces organismes ont conduit certains à faire la «une» des médias, comme la bactérie Deinococcus radiodurans, découverte en 1956 dans une boîte de conserve irradiée aux rayons gamma, ou encore Halomonas titanicae, une bactérie prélevée sur le Titanic en 1991, capable de résister à des milieux très salés et rongeant les parties métalliques du navire, au point de menacer de le faire disparaître.
Quant à la bactérie Thermus aquaticus, découverte en 1969 par Thomas D. Brock et Hudson Freeze dans le Parc national de Yellowstone, elle doit sa célébrité à la production d’une protéine spécifique, Taq polymérase, une enzyme résistante à la chaleur, qui lui permet de supporter ces hautes températures. Cette enzyme est en effet active autour de 70 ou 80 degrés Celsius.
L’enzyme résistante à la chaleur
Cette découverte n’est pas anodine : elle va mener à l’invention de la polymerase chain reaction, ou PCR (on se souvient des tests PCR), une réaction enzymatique permettant de sélectionner, puis d’amplifier en très grande quantité un fragment d’ADN particulier. «Il n’est généralement pas possible d’observer un fragment d’ADN sans l’amplifier, c’est trop petit», indique Ianina Altshuler. Cette technique a donc révolutionné et démocratisé le séquençage de l’ADN, aujourd’hui une technique de routine dans les laboratoires, qui sert aussi bien à poser des diagnostics médicaux, à identifier des mutations génétiques qu’à des applications en criminologie, en agronomie ou en environnement. Kary B. Mullis recevra pour cela le Prix Nobel de chimie en 1993. À cette époque, le séquençage de l’ADN est déjà possible, mais les méthodes sont beaucoup plus longues et plus chères.
Et si une enzyme résistante à la chaleur a permis cela, c’est parce que recopier de l’ADN suppose une succession de cycles chaud-froid, nécessitant de chauffer pour que l’ADN s’ouvre, puis refroidir pour que l’enzyme puisse recopier avant que l’ADN ne se referme, etc. Or les enzymes les plus courantes fonctionnent plutôt vers 30 degrés Celsius. Pendant la PCR, la Taq polymérase résiste donc aux alternances de température nécessaires et n’est pas détruite.
Aquaporine
Aqua, eau; poros, passage. Ces protéines sont les gendarmes de l’eau, dont les postes-frontières se situent dans les membranes cellulaires de tout le vivant, des bactéries aux mammifères, en passant par la levure et les plantes. En forme de sablier, elles permettent de laisser passer l’eau de manière sélective. Ainsi, pour éviter tout intrus, les molécules de H2O s’enfilent dans ce canal à la queue leu leu. Une telle efficacité, tant dans la perméabilité que dans le filtrage, pourrait trouver des applications dans le domaine médical, pour par exemple améliorer les dialyses, ou l’ingénierie pour le dessalement de l’eau de mer. L’aquaporine est aussi une des cibles du traitement du glaucome, maladie liée à l’humeur aqueuse dans le globe oculaire. La découverte des aquaporines a valu à l’Américain Peter Agre le Prix Nobel de chimie en 2003.