Le laser améliore la résolution temporelle de la cryoEM
En 2017, Jacques Dubochet, Joachim Frank et Richard Henderson ont remporté le prix Nobel de chimie pour leur contribution à la cryo-microscopie électronique (cryoEM), une technique d’imagerie qui peut capturer avec une précision atomique des images de biomolécules comme les protéines.
En cryoEM, les échantillons sont placés dans de la glace vitreuse, une forme de glace ressemblant à du verre qui est obtenue lorsque l’eau est gelée si rapidement que la cristallisation ne peut pas se produire. Une fois l’échantillon vitrifié, des images haute résolution de sa structure moléculaire peuvent être prises avec un microscope électronique, un instrument qui forme des images à l’aide d’un faisceau d’électrons à la place de la lumière.
La cryoEM a ouvert de nouvelles dimensions en sciences de la vie, chimie et médecine. Par exemple, elle a récemment été utilisée pour mapper la structure de la protéine S du SARS-CoV-2, qui est la cible de nombreux vaccins de COVID-19.
Les protéines changent constamment leur structure 3D dans la cellule. Ces réagencements conformationnels sont indispensables aux protéines pour remplir leurs fonctions spécifiques, et se produisent en quelques millionièmes à millièmes de seconde. De tels mouvements sont trop rapides pour être observés en temps réel par les protocoles cryoEM actuels, ce qui ne nous permet pas de comprendre complètement les protéines.
Mais une équipe de scientifiques dirigés par Ulrich Lorenz de la Faculté des Sciences de Base de l’EPFL a mis au point une méthode cryoEM qui peut capturer des images de mouvements de protéines à la microseconde (un millionième de seconde). Leurs travaux sont publiés dans Chemical Physics Letters.
Cette méthode implique la fusion rapide de l’échantillon vitrifié avec une impulsion laser. Lorsque la glace devient liquide, il y a une fenêtre de temps modulable dans laquelle la protéine peut être incitée à se mouvoir de la même manière que dans son état liquide naturel dans la cellule.
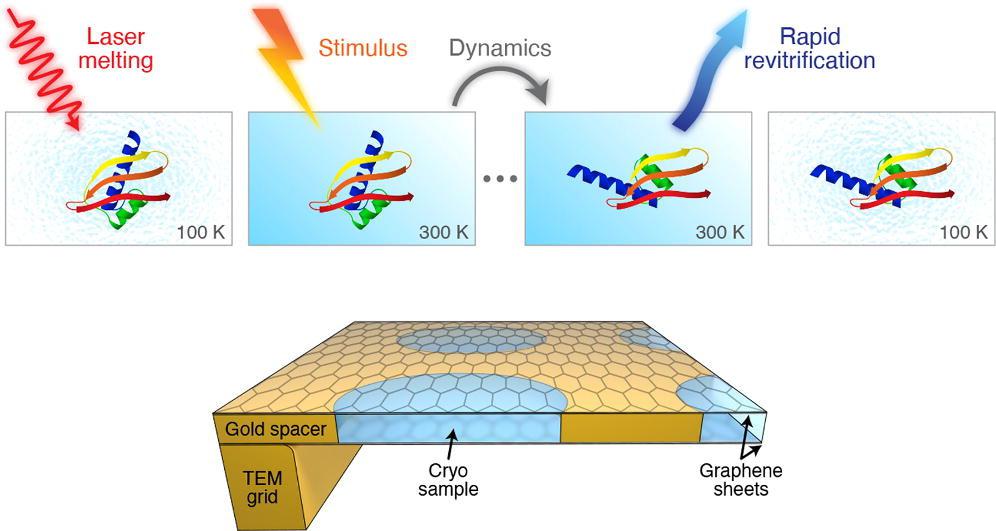
«Généralement, le réchauffement d’un échantillon cryogénique le dévitrifie», explique Ulrich Lorenz. «Mais nous pouvons contourner cet obstacle selon la rapidité avec laquelle nous faisons fondre l’échantillon.»
Après l’impulsion laser, l’échantillon est re-vitrifié en seulement quelques microsecondes, piégeant les particules dans leur configuration transitoire. Dans cet état «en pause», elles peuvent désormais être observées avec les méthodes cryoEM traditionnelles.
«La mise en correspondance de la résolution temporelle de la cryoEM avec la fenêtre de temps naturelle des protéines nous permettra d’étudier directement des processus qui étaient auparavant inaccessibles», ajoute Ulrich Lorenz.
L’équipe de scientifiques a testé sa nouvelle méthode en décomposant les protéines après avoir endommagé leur structure et après les avoir piégées dans une configuration partiellement défaite.
