«Avatars», um Lymphome personalisiert zu behandeln
Krebs ist bekanntlich sehr komplex, und jeder Tumor spricht auf unterschiedliche Therapien an. Dies gilt auch für Lymphome, eine Art von Blutkrebs, der von Lymphozyten ausgeht, einer Untergruppe von Immunzellen, die zur Bekämpfung von Infektionen beitragen. Die Forschenden suchen ständig nach Möglichkeiten, die beste Therapie für jeden Patienten zu ermitteln.
Die herkömmlichen Methoden zur Prüfung der Wirksamkeit von Therapien bei Lymphomen sind begrenzt. So sind beispielsweise aus Patienten gewonnene Xenotransplantationsmodelle, bei denen menschliche Tumore in Mäusen gezüchtet werden, zwar wirksam, aber auch langsam und teuer. Ausserdem erfassen sie die Vielfalt der Interaktionen zwischen Tumor und Immunzellen nicht vollständig.
In jüngster Zeit haben Forschende damit begonnen, «Tumor-Avatare» zu entwickeln – das sind neue Systeme zur Erhaltung von Zellen oder Gewebeproben ausserhalb des Körpers des Patienten (ex vivo). Tumor-Avatare sind recht vielversprechende Instrumente. Bei Lymphomen war es jedoch besonders schwierig, die ursprüngliche Struktur und Zellzusammensetzung zu erhalten.
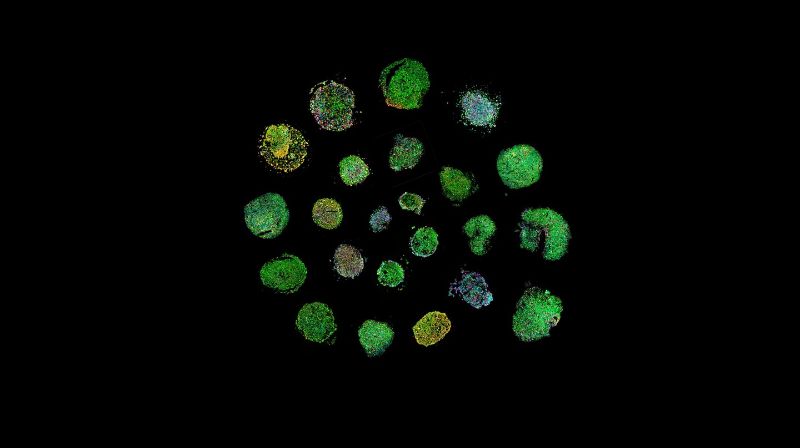
Um diese Herausforderungen zu meistern, entwickelten Albert Santamaria-Martínez und Elisa Oricchio von der EPFL in enger Zusammenarbeit mit Klinikern des CHUV ein fortschrittliches Ex-vivo-Modell, die so genannten «Lymphomoide»: Sie identifizierten eine spezifische Umgebung, die es erlaubt, Fragmente von Lymphomgewebe mehrere Tage lang ex vivo zu erhalten. Unter diesen Bedingungen konnten sie die Architektur des Tumors, die zelluläre Vielfalt und die Mikroumgebung erhalten.
Die Forschenden sammelten 27 menschliche Lymphom-Proben und wiesen mit Hilfe von bildgebenden Analysen und räumlichen Molekularprofilen nach, dass Lymphomoide die phänotypischen und molekularen Merkmale der ursprünglichen Tumoren erhalten.
Lymphomoide bieten eine neue Möglichkeit zur Personalisierung der Krebsbehandlung
In einer Studie mit verschiedenen Arten menschlicher B-Zell-Lymphome wurden Lymphomoide mehrere Tage lang am Leben und strukturell intakt gehalten, so dass die Forschenden untersuchen konnten, wie die Proben auf verschiedene Medikamente reagierten. Das Team testete eine Reihe von Krebsmedikamenten an den Lymphomzellen, darunter Bruton-Tyrosinkinase (BTK)-Inhibitoren, PI3K-Inhibitoren und BCL-2-Inhibitoren, um festzustellen, ob diese Behandlungen das Wachstum und die Vermehrung von Lymphomzellen verringern können.
Die Lymphoide zeigten eine Reihe von Empfindlichkeiten gegenüber Krebsmedikamenten, die sich eng an die klinischen Reaktionen der Patienten anlehnen, deren Gewebeproben verwendet wurden. So zeigten Lymphomzellen eines Patienten, dessen Tumor gut auf BTK-Inhibitoren ansprach, auch eine Empfindlichkeit gegenüber demselben Medikament im Ex-vivo-Modell. In einem anderen Fall zeigten Lymphknoten eines Patienten, der gegen Lenalidomid resistent war, eine ähnliche Resistenz bei Ex-vivo-Tests.
Dies deutet darauf hin, dass Lymphknoten als zuverlässiges Instrument zur Vorhersage dienen können, wie einzelne Patienten auf bestimmte Behandlungen ansprechen könnten. Indem sie es den Forschenden ermöglichen, die Wirksamkeit von Arzneimitteln an vom Patienten stammenden Proben zu testen, bieten Lymphomoide eine vielversprechende neue Möglichkeit zur Personalisierung der Krebsbehandlung. Sie könnten es den Ärzten schliesslich ermöglichen, anhand der Gewebeprobe eines Patienten die wirksamste Behandlung für diesen Patienten zu finden, bevor die Therapie beginnt, was den Patienten unnötige Behandlungen und Nebenwirkungen ersparen könnte.
Darüber hinaus könnten Lymphomoide auch in klinischen Studien eingesetzt werden, um neue Krebstherapien zu testen und die komplexe Dynamik zwischen Tumorzellen und Immunzellen während der Behandlung zu erforschen.