Ein Virus zur Erkennung kleiner Peptid-Imitate von Frostschutzproteinen
Einige Organismen haben spezielle «Antifreeze»-Proteine entwickelt, die sie bei Minusgraden überleben lassen. Diese Proteine verhindern Eisbildung, indem sie sich an Eiskristalle binden, sobald diese entstehen. Doch wie sie genau funktionieren, bleibt ein Rätsel: «Eisbildung ist eine grosse Bedrohung für Organismen, weil sie ihre Zellen zerstört und sie schliesslich tötet», sagt Corey Stevens, Wissenschaftler am Polymers Laboratory der EPFL-Fakultät für Ingenieurwissenschaft und Technologie.
Eine Schlüsselrolle bei der Zell- und Gewebekonservierung
Die drohende Eisbildung ist in vielen Bereichen ein grosses Hindernis, insbesondere wenn es um die Lagerung von menschlichem Blut, Zellen und sogar Organen für die Transplantation geht. Organe können nur wenige Stunden im Kühllager aufbewahrt werden, bevor sie unbrauchbar werden, und bei der Kryokonservierung von Zellen wird nur ein Bruchteil wiedergewonnen. Gefrierschutzproteine könnten eine Möglichkeit sein, dieses Problem zu umgehen – und könnten dazu führen, dass viel mehr Menschen zellbasierte Therapien erhalten, indem sie die Lagerung und den Transport von Zellen verbessern. Doch zunächst müssen Forschende die Mechanismen hinter diesen Proteinen besser verstehen, um synthetische Verbindungen mit den gleichen Eigenschaften herstellen zu können.
Screening von Millionen von Verbindungen, um die richtige zu finden
EPFL-Forschende haben in Zusammenarbeit mit Kollegen der University of Warwick ein Peptid isoliert, das sich an Eis binden und die Bildung von Eiskristallen verhindern kann, genau wie es Frostschutzproteine tun. Um dieses Peptid zu finden, verwendeten sie eine Methode namens Phagen-Display. Phagen sind Viren, die mehrere Kopien eines Peptids auf ihrer Oberfläche haben und mit denen Peptide identifiziert werden können, die in der Lage sind, an eine andere spezifische Oberfläche zu binden – wie Eis. Die Wissenschaftlerinnen durchsuchten eine Bibliothek von Milliarden von Phagen, jeder mit einem anderen Peptid, um die besten Kandidaten zu finden. Dann verstärkten sie diese Peptide und eliminierten die anderen, und wiederholten diesen Prozess mehrere Male. Am Ende fanden sie ein zyklisches Peptid mit 14 Aminosäuren, das besonders gut an Eis bindet.
«Da wir immer noch nicht vollständig verstehen, wie Frostschutzproteine funktionieren, können wir noch keine synthetischen Verbindungen entwerfen, die sie nachahmen», sagt Harm-Anton Klok, Professor an der EPFL und Leiter des Polymere-Labors. «Für unsere Forschung haben wir uns daher entschieden, den umgekehrten Weg zu gehen – wir haben mit Milliarden von Verbindungen begonnen und sind sie eine nach der anderen durchgegangen, um diejenigen zu finden, die die von uns gesuchten Eigenschaften haben.» Ihre Ergebnisse wurden in Nature Communications veröffentlicht.
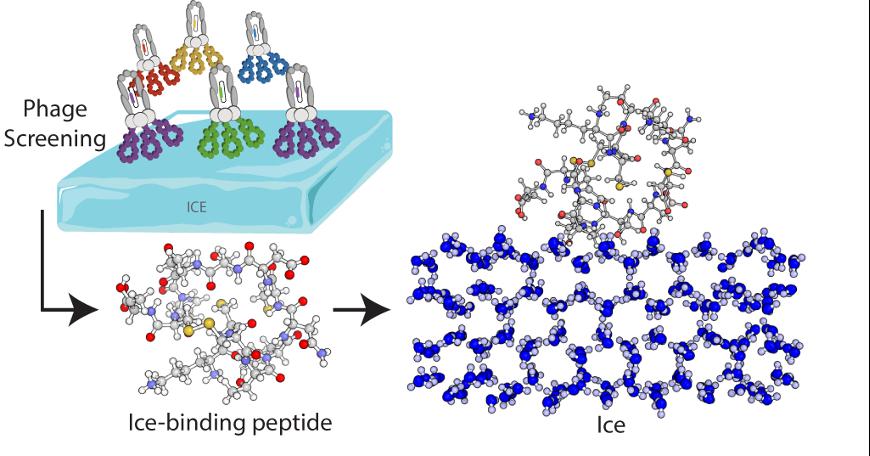
Forschende haben ein Peptid isoliert, das an Eis binden und die Bildung von Eiskristallen verhindern kann, so wie es Frostschutzproteine tun. © Polymers Laboratory / EPFL
