Infizieren oder resistent gegen Antibiotika werden – das ist das Dilemma
Stellen Sie sich vor, Sie versuchen, sich in einem neuen Zuhause einzuleben, während Sie ständig angegriffen werden. So ergeht es dem Bakterium Pseudomonas aeruginosa, wenn es die Lunge infiziert und sich nicht gleichzeitig ausbreiten und vor Antibiotika schützen kann. Dennoch ist es einer der Hauptverursacher von Krankenhausinfektionen und berüchtigt dafür, lang anhaltende, antibiotikaresistente Infektionen zu verursachen, die vor allem bei Menschen mit Lungenkrankheiten wie Mukoviszidose, COPD oder Bronchiektasen Schäden verursachen.
Um unter schwierigen Bedingungen zu überleben, bildet P. aeruginosa Kolonien, die als «Biofilme» bekannt sind – Bakteriencluster, die von einer selbstproduzierten Matrix umhüllt sind, welche ihnen erhebliche Vorteile bietet, darunter Schutz vor Antibiotika.
Doch Biofilme haben ihren Preis: Die Bakteriencluster verlieren auch die Fähigkeit, sich zu bewegen, Nährstoffe zu finden und sich effektiv auszubreiten. Für P. aeruginosa, welches eine Lunge infiziert, stellt dies ein Dilemma dar: Soll es sich über die Oberfläche der Lunge ausbreiten oder sich in einem Bunker einnisten, um den eintreffenden Antibiotika zu widerstehen? Das Erreichen des richtigen Gleichgewichts kann für den Erreger über Leben und Tod entscheiden – und eine Störung dieses Gleichgewichts kann für die Patienten Leben und Tod bedeuten.
Neue Forschungsarbeiten der Gruppe von Alexandre Persat am Global Health Institute der EPFL haben nun aufgedeckt, wie P. aeruginosa den Zielkonflikt zwischen Besiedlung und Überleben während einer Infektion meistert. Es tut dies indem es je nach Umweltdruck zwischen Biofilmbildung zum Schutz vor Antibiotika und einem mobileren, «planktonischen» Zustand zur Ausbreitung und zum Zugang zu Nährstoffen wechselt. Die Studie wurde in Nature Microbiology veröffentlicht.

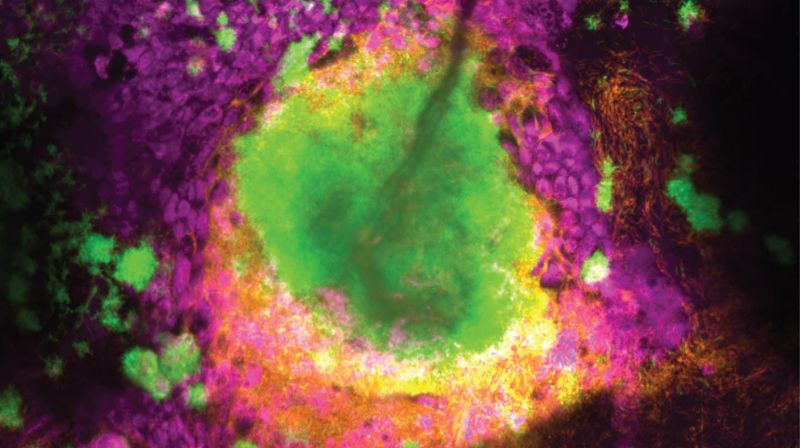
Zellen von Pseudomonas aeruginosa (orange), die auf der Schleimschicht (grün) der Schleimhaut der Atemwege wachsen. Die Epithelzellen der Atemwege sind in lila dargestellt. Bildrechte: Lucas Meirelles (EPFL)
Nachahmung der natürlichen Infektionsumgebung zur Beobachtung der Bakterien
Um das Verhalten von P. aeruginosa besser zu verstehen, züchteten die Forschenden die Bakterien auf mit Schleim bedeckten Gewebemodellen, welche die menschliche Lunge nachahmen. Diese als «Organoide» bezeichneten Gewebemodelle gehören zur Spitzenklasse des Bioengineering.
«Wir haben dann eine Hochdurchsatz-Screening-Technik namens Transposon-Insertionssequenzierung (Tn-seq) in Kombination mit Stoffwechselmodellierung und Live-Bildgebung eingesetzt, um zu untersuchen, wie sich P. aeruginosa an die Besiedlung der Lungenschleimhaut anpasst und eine Antibiotikabehandlung verträgt», sagt Lucas Meirelles, der die Studie leitete.
Dank der Tn-seq-Technik konnten die Wissenschaftler und Wissenschaftlerinnen feststellen, welche Gene für das Überleben des Bakteriums unter verschiedenen Bedingungen wichtig sind: diejenigen, die zur Fitness während der Schleimhautbesiedlung beitragen, und diejenigen, die dem Bakterium helfen, Antibiotika zu vertragen.
Ausserdem simulierten die Forschenden mit Hilfe von Computermodellen, wie die Bakterien Nährstoffe in der Lungenumgebung verstoffwechseln, was dazu beitrug, die genauen Stoffwechselwege zu ermitteln, auf die P. aeruginosa während der Infektion angewiesen ist.
Das richtige Gleichgewicht finden
Die Studie ergab, dass sich P. aeruginosa an den Lungenschleim anpasst, indem es auf Zucker und Laktat zurückgreift, Nährstoffe, die in infizierten Lungen reichlich vorhanden sind. Um auf dem Schleim zu überleben, muss das Bakterium jedoch auch essenzielle, aber weniger verfügbare Nährstoffe wie Aminosäuren synthetisieren. Diese Selbstversorgung oder «metabolische Unabhängigkeit» hilft dem Bakterium, in den frühen Stadien der Lungeninfektion zu gedeihen.
Das Team von Persat hat den Mechanismus hinter diesem Dilemma aufgedeckt. Sie fanden heraus, dass die Biofilmbildung eine «metabolische Belastung» darstellt, d. h. die Herstellung der klebrigen Matrix, die den Biofilm zusammenhält, verbraucht Ressourcen und verlangsamt die Ausbreitungsfähigkeit der Bakterien. In Experimenten verbreiteten sich Bakterien, die keine Biofilme bilden konnten, effizienter, blieben aber anfällig für Antibiotika. Dieser neue Einblick in die metabolischen Kosten der Biofilmbildung erklärt, wie das Bakterium Wachstum und Antibiotikatoleranz ausbalanciert.
Die Studie unterstreicht den heiklen Balanceakt, den Pseudomonas aeruginosa bei Infektionen vollziehen muss. Während die Bakterien die Lunge effektiv besiedeln müssen, schränkt ihre beste Überlebensstrategie – die Bildung von Biofilmen – ihren Zugang zu Nährstoffen und damit ihre Fähigkeit zur Ausbreitung ein. Sobald jedoch Antibiotika eingeführt werden, wird die Biofilmbildung vorteilhaft und schützt die Bakterien vor ihrer Ausrottung.
Neue Wege beschreiten
Die Entdeckung öffnet die Tür für die Erforschung neuer Behandlungsstrategien: Wenn wir einen Weg finden, die Fähigkeit der Bakterien zur Bildung von Biofilmen zu stören, ohne ihnen mehr Raum zur Ausbreitung zu geben, könnte dies sie anfälliger für bestehende Behandlungen machen. Und Therapien, die auf die Stoffwechselwege der Bakterien abzielen, könnten sich ebenfalls als wirksam erweisen, um Pseudomonas-Infektionen zu schwächen.
Generell sind die Wissenschaftlerinnen und Wissenschaftler der Ansicht, dass die Untersuchung von Krankheitserregern wie P. aeruginosa in Infektionsmodellen, die die Physiologie des menschlichen Gewebes nachbilden, für die Bekämpfung der Antibiotikaresistenz von entscheidender Bedeutung ist.
«Antibiotikaresistenzen werden sich zu einer der grössten Herausforderungen im Gesundheitswesen dieses Jahrhunderts entwickeln, und P. aeruginosa trägt wesentlich zu diesem Problem bei», sagt Meirelles, «Durch die Nachbildung der Atemwegsumgebung im Labor mittels Tissue Engineering wollen wir die Physiologie dieses Erregers besser verstehen. Wir hoffen, dass wir dadurch bisher unbekannte Angriffspunkte finden, die uns helfen, diese Infektionen zu bekämpfen und die Antibiotikaresistenz zu überwinden.»