L'imagerie nanoplasmonique révèle la sécrétion de protéines
Les sécrétions cellulaires telles que les protéines, les anticorps et les neurotransmetteurs jouent un rôle essentiel dans la réponse immunitaire, le métabolisme et la communication entre les cellules. Il est indispensable de comprendre les sécrétions cellulaires pour développer des traitements contre les maladies. Toutefois, les méthodes actuelles permettent seulement d’indiquer la quantité de sécrétions, sans précision sur le moment et le lieu de leur production.
Des scientifiques du Laboratoire de systèmes bionanophotoniques (BIOS) de la Faculté des sciences et techniques de l’ingénieur et de l’Université de Genève ont mis au point une nouvelle méthode d’imagerie optique qui permet d’obtenir une vue quadridimensionnelle des sécrétions cellulaires dans l’espace et dans le temps. En plaçant des cellules individuelles dans des puits microscopiques d’une puce plaquée or nanostructurée, puis en induisant un phénomène appelé résonance plasmonique à la surface de la puce, ils peuvent cartographier les sécrétions en cours de production, tout en observant la forme et le mouvement des cellules.
Parce qu’elle offre une vue détaillée sans précédent du fonctionnement et de la communication des cellules, les scientifiques estiment que leur méthode, récemment publiée dans la revue Nature Biomedical Engineering, recèle un immense potentiel pour le développement pharmaceutique et la recherche fondamentale.
«Elle nous permet de cribler les cellules individuellement avec un rendement élevé, ce qui est essentiel dans notre travail. Les mesures collectives de la réponse moyenne de nombreuses cellules ne reflètent pas leur hétérogénéité. Et en biologie, tout est hétérogène, des réponses immunitaires aux cellules cancéreuses. C’est pourquoi le cancer est si difficile à traiter», déclare Hatice Altug, responsable du laboratoire BIOS.
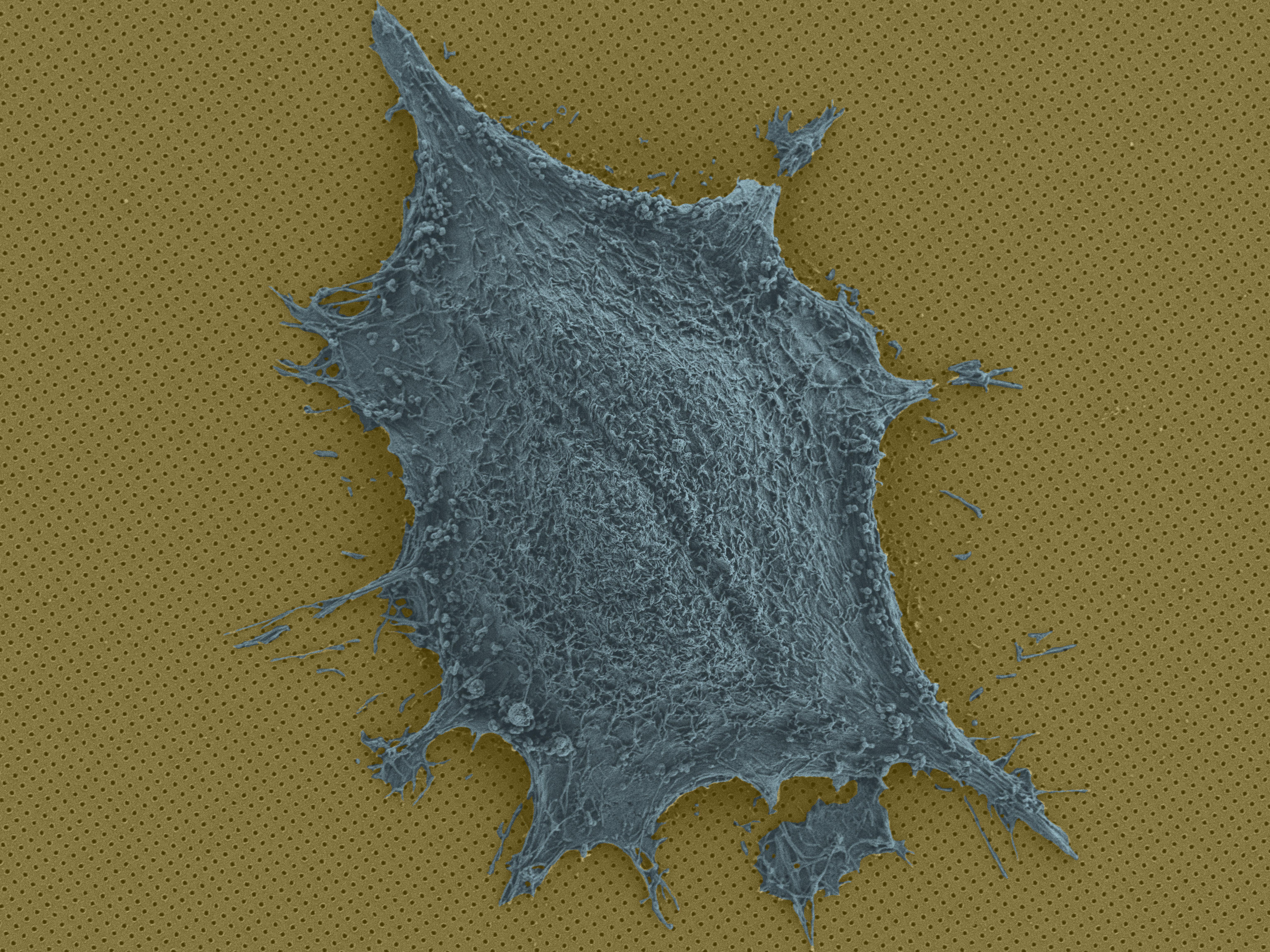
Cellule unique sur une puce © BIOS EPFL
Un million d’éléments détecteurs
L’élément de base de la méthode des scientifiques se résume à une puce nanoplasmonique de 1 cm2 composée de millions de trous minuscules et de centaines de chambres pour les cellules individuelles. La puce est constituée d’un substrat d’or nanostructuré recouvert d’un filet mince en polymère. Chaque chambre est remplie d’un milieu cellulaire pour maintenir les cellules en vie et en bonne santé pendant l’imagerie.
«Les sécrétions cellulaires sont comme les “paroles” de la cellule: elles se dispersent de manière dynamique dans le temps et l’espace pour entrer en contact avec d’autres cellules. Notre technologie permet de capturer une hétérogénéité essentielle, c’est-à-dire où et jusqu’où ces “paroles” voyagent», explique Saeid Ansaryan, doctorant au laboratoire BIOS et principal auteur.
La partie nanoplasmonique intervient grâce à un faisceau lumineux qui fait osciller les électrons d’or. La nanostructure est conçue de sorte que seules certaines longueurs d’onde puissent la pénétrer. Lorsqu’un phénomène, comme la sécrétion d’une protéine, se produit à la surface de la puce et change la lumière qui la traverse, le spectre se modifie. Un capteur d’image CMOS (Complementary Metal Oxide Semiconductor) et une LED traduisent ce changement en variations d’intensité sur les pixels CMOS.
«L’intérêt de notre appareil est que les nanotrous répartis sur toute la surface transforment chaque point en un élément détecteur. Cela nous permet d’observer les schémas spatiaux des protéines libérées indépendamment de la position de la cellule», affirme Saeid Ansaryan.
Cette méthode a permis aux scientifiques d’avoir un aperçu de deux processus cellulaires essentiels – la division et la mort cellulaires – et d’étudier les cellules B humaines délicates sécrétant des anticorps.
«Nous avons vu le contenu cellulaire libéré lors de deux formes de mort cellulaire, l’apoptose et la nécroptose. Dans cette dernière, le contenu est libéré en rafale asymétrique, ce qui entraîne une signature d’image ou une empreinte. Cela n’a jamais été démontré au niveau d’une seule cellule», indique Hatice Altug.

Réseau de micropuits à cellule unique © BIOS EPFL
Criblage de l’aptitude cellulaire
La méthode consistant à immerger les cellules dans un milieu cellulaire nutritif et ne nécessitant pas des marqueurs fluorescents toxiques utilisés par d’autres technologies d’imagerie, les cellules étudiées peuvent être facilement récupérées. Cela donne à cette méthode un grand potentiel pour le développement de médicaments, de vaccins et d’autres traitements, par exemple, pour aider les scientifiques à comprendre comment les cellules réagissent à différentes thérapies au niveau individuel.
«Étant donné que la quantité et le type de sécrétions produites par une cellule permettent de déterminer son efficacité globale, nous pourrions également imaginer des applications d’immunothérapie dans lesquelles on criblerait les cellules immunitaires de la patiente ou du patient pour identifier celles qui sont les plus efficaces, puis on créerait une colonie de ces cellules», explique Saeid Ansaryan.