Infecter ou résister aux antibiotiques? Tel est le dilemme.
Imaginez que vous essayez de vous installer dans une nouvelle maison tout en étant constamment attaqué. C’est ce à quoi fait face la bactérie Pseudomonas aeruginosa lorsqu’elle infecte les poumons. Difficile pour elle de se propager tout en se protégeant des antibiotiques. Néanmoins, elle est l’une des principales responsables des infections nosocomiales et est connue pour causer des infections prolongées qui résistent aux antibiotiques, entraînant des dommages en particulier chez les personnes atteintes de maladies pulmonaires comme la mucoviscidose, la BPCO ou la bronchectasie.
Pour survivre à des conditions difficiles, P. aeruginosa forme des colonies appelées «biofilms», c’est-à-dire des amas de bactéries enfermées dans une matrice autoproduite qui leur procure des avantages significatifs, notamment une protection contre les antibiotiques.
Mais les biofilms ont un coût: les bactéries en grappes perdent également la capacité de se déplacer, de trouver des éléments nutritifs et de se propager efficacement. Pour la bactérie P. aeruginosa qui infecte un poumon, cela pose un dilemme: doit-elle s’étendre à la surface du poumon ou se retrancher pour résister aux antibiotiques? Atteindre le bon équilibre peut signifier la vie ou la mort de l’agent pathogène – et le perturber peut signifier la vie ou la mort des patientes et patients.
De nouvelles recherches menées par l’équipe d’Alexandre Persat de l’Institut d’infectiologie de l’EPFL ont révélé comment P. aeruginosa gère le compromis entre colonisation et survie pendant l’infection en passant de la formation d’un biofilm pour protéger les antibiotiques à un état «planctonique» plus mobile pour se propager et accéder aux nutriments, en fonction des pressions environnementales auxquelles elle est confrontée. L’étude a été publiée dans Nature Microbiology.

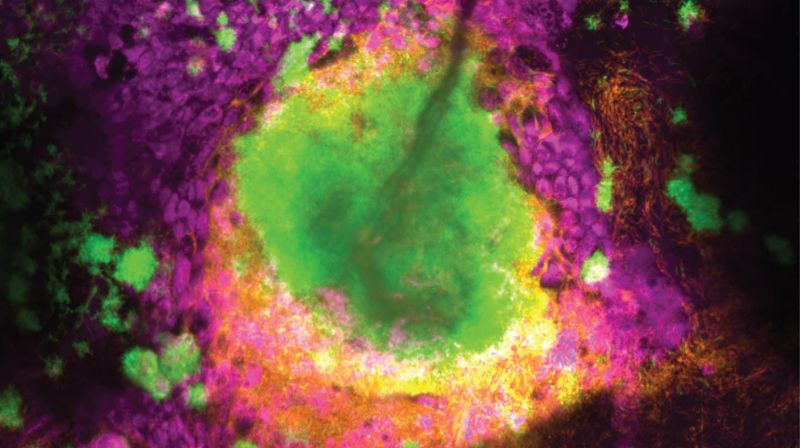
Cellules de Pseudomonas aeruginosa (orange) se développant sur la couche de mucus (vert) de la muqueuse des voies respiratoires. Les cellules épithéliales des voies respiratoires sont représentées en violet. Crédit : Lucas Meirelles (EPFL).
Reproduire les environnements infectieux naturels pour observer les bactéries
Pour mieux comprendre le comportement de P. aeruginosa, les chercheuses et chercheurs ont cultivé les bactéries sur des modèles de tissus recouverts de mucus qui reproduisent les poumons humains. Ces modèles tissulaires, appelés «organoïdes», sont à la pointe de la bio-ingénierie.
«Nous avons ensuite utilisé une technique de criblage à haut débit appelée séquençage par insertion de transposons (Tn-seq), associée à la modélisation métabolique et à l’imagerie en direct, pour étudier comment P. aeruginosa s’adapte pour coloniser la surface de la muqueuse du poumon et tolérer les traitements antibiotiques», explique Lucas Meirelles, qui a dirigé l’étude.
Grâce à la technique Tn-seq, les scientifiques ont identifié les gènes importants pour la survie de la bactérie dans différentes conditions: ceux qui contribuent à l’adaptation pendant la colonisation des muqueuses et ceux qui aident la bactérie à tolérer les antibiotiques.
Les scientifiques ont également utilisé la modélisation informatique pour simuler la façon dont les bactéries métabolisent les nutriments dans l’environnement pulmonaire, ce qui a aidé à déterminer précisément les voies métaboliques exactes sur lesquelles P. aeruginosa s’appuie pendant l’infection.
Trouver le juste équilibre
L’étude a révélé que P. aeruginosa s’adapte au mucus pulmonaire en s’appuyant sur les sucres et le lactate, des nutriments présents en abondance dans les poumons infectés. Cependant, pour survivre sur le mucus, la bactérie doit aussi synthétiser des nutriments essentiels mais moins disponibles, comme les acides aminés. Cette autosuffisance, ou «indépendance métabolique», aide la bactérie à se développer dans les premiers stades de l’infection pulmonaire.
Ce que l’équipe d’Alexandre Persat a découvert, c’est le mécanisme à l’origine de ce dilemme. Ils se sont aperçus que la formation de biofilm impose un «fardeau métabolique». Autrement dit, la production de la matrice collante qui maintient le biofilm consomme des ressources, ce qui ralentit la capacité de propagation des bactéries. Dans les expériences, les bactéries qui ne pouvaient pas former de biofilms se propageaient plus efficacement, mais sont restées vulnérables aux antibiotiques. Ce nouvel éclairage sur les coûts métaboliques de la formation de biofilm explique comment la bactérie concilie croissance et tolérance aux antibiotiques.
L’étude met en évidence le délicat exercice d’équilibrage que doit effectuer Pseudomonas aeruginosa lors d’infections. Bien que les bactéries aient besoin de coloniser efficacement les poumons, leur meilleure stratégie de survie – la formation de biofilms – limite leur accès aux nutriments et, par conséquent, leur capacité à se propager. Cependant, une fois que les antibiotiques sont introduits, la formation de biofilm devient avantageuse, empêchant les bactéries d’être éliminées.
Explorer de nouvelles voies
Cette découverte ouvre la voie à l’exploration de nouvelles stratégies thérapeutiques: si nous parvenons à perturber la capacité des bactéries à former des biofilms sans leur laisser plus de place pour se propager, cela pourrait les rendre plus vulnérables aux traitements existants. Et les traitements qui ciblent les voies métaboliques de la bactérie peuvent également s’avérer efficaces pour atténuer les infections à Pseudomonas.
De manière plus générale, les scientifiques estiment que l’étude de pathogènes tels que P. aeruginosa dans des modèles d’infection qui reproduisent la physiologie des tissus humains est essentielle pour lutter contre la résistance aux antibiotiques.
«La résistance aux antibiotiques est appelée à devenir l’un des défis sanitaires les plus graves de ce siècle, et P. aeruginosa est un acteur majeur de ce problème, déclare Lucas Meirelles. En recourant à l’ingénierie tissulaire pour reproduire l’environnement des voies aériennes en laboratoire, nous cherchons à mieux comprendre la physiologie de cet agent pathogène. Nous espérons ainsi découvrir des cibles jusqu’alors inconnues pour nous aider à combattre ces infections et à lutter contre la résistance aux antibiotiques.»