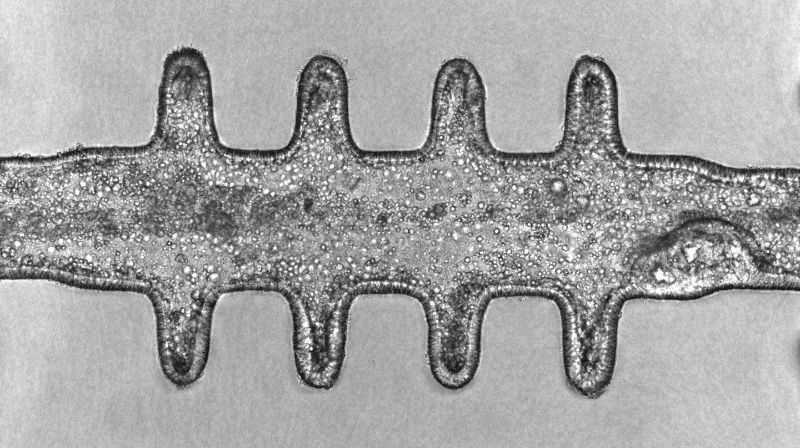
Minikolons revolutionieren die Darmkrebsforschung
In unserem Kampf gegen den Krebs ist die Suche nach ausgefeilteren und realistischeren Modellen zur Untersuchung der Tumorentwicklung so wichtig wie nie zuvor. Bislang hat sich die Forschung auf Tiermodelle und vereinfachte Zellkulturmethoden verlassen, die zwar wertvoll sind, aber das komplexe Zusammenspiel der an der Tumorentwicklung beteiligten Faktoren nicht vollständig erfassen können.
Selbst neuere, fortschrittlichere Modelle zur Untersuchung von Krebs, wie Organoide – winzige, im Labor gezüchtete Versionen von Organen – bilden das Zellverhalten und die Gewebestrukturen, wie sie in echten Tumoren vorkommen, nicht genau nach.
Diese Lücke hat unser Verständnis der komplizierten Prozesse, die der Krebsentstehung, dem Fortschreiten der Erkrankung und dem Ansprechen auf die Behandlung zugrunde liegen, erheblich beeinträchtigt und erfordert anspruchsvollere Modelle, die die Komplexität der Krankheit genau nachbilden.
In einem bedeutenden Fortschritt für die Krebsmodellierung haben Forschende Mikrofabrikations- und Tissue-Engineering-Techniken kombiniert, um Miniatur-Darmgewebe zu entwickeln, die den komplexen Prozess der Tumorentstehung ausserhalb des Körpers mit hoher Genauigkeit simulieren können, so dass Tumore entstehen, die denen in vivo sehr ähnlich sind.
Der jetzt in Nature veröffentlichte Durchbruch wurde von Luis Francisco Lorenzo Martín, Tania Hübscher und anderen Mitgliedern der Gruppe von Matthias Lütolf an der EPFL erzielt, unterstützt von der Gruppe von Freddy Radtke (EPFL) und Kolleginnen am Institut für Humanbiologie von Roche.
Die Mini-Kolons sind topobiologisch komplex, d.h. sie bilden nicht nur die physische Struktur des Dickdarmgewebes nach, einschliesslich seiner charakteristischen Krypten- und Lumen-Architektur, sondern auch die zelluläre Vielfalt, die in gesundem und krankem Zustand im tatsächlichen Dickdarmgewebe vorhanden ist.
Optogenetik: Den Krebs «anschalten»
Eine weitere wichtige Eigenschaft der Minikolons ist, dass sie dazu gebracht werden können, «nach Belieben» und in bestimmten Bereichen Tumore zu entwickeln – ein enormer Vorteil für die Krebsforschung. Den Forschenden gelang es, induzierbare onkogene Gene mit Hilfe der «Optogenetik» einzuschalten. Diese innovative Technik nutzt Licht, um biologische Prozesse wie die Genexpression zu steuern.
Durch die Integration eines auf blaues Licht reagierenden Systems in die Minikolons konnten die Forschenden diese dazu bringen, kontrollierte onkogene Mutationen zu durchlaufen, die die Tumorevolution mit noch nie dagewesenen Details offenlegen können. Dieser optogenetische Ansatz ermöglichte es den Wissenschaftlerinnen, gezielte Veränderungen in bestimmten Zellpopulationen innerhalb der Minikolons herbeizuführen und so das lokale Auftreten von Darmkrebs im Körper zu imitieren.
«Im Wesentlichen haben wir Licht eingesetzt, um die Tumorgenese auszulösen, indem wir onkogene Treibermutationen in gesunden biotechnisch hergestellten Epithelorganoiden des Dickdarms räumlich und zeitlich kontrolliert aktiviert haben», sagt Matthias Lütolf, der auch Gründungsdirektor des neuen Instituts für Humanbiologie von Roche ist. «Damit kann man die Tumorbildung in Echtzeit beobachten und sehr detaillierte Analysen eines Prozesses durchführen, der in der Maus nur sehr schwer zu untersuchen ist.»
Die Möglichkeit, diese genetischen Veränderungen mit Licht in den Miniaturdärmen auszulösen, ermöglicht nicht nur eine kontrolliertere und präzisere Aktivierung der Onkogene, sondern bietet auch ein leistungsfähiges Instrument, um die dynamischen Prozesse der Tumorentwicklung und die zelluläre Reaktion auf diese Mutationen in Echtzeit zu untersuchen. Dieser innovative Einsatz der Optogenetik eröffnet neue Möglichkeiten für die Erforschung der molekularen und zellulären Mechanismen von Krebs.
Durch die Manipulation von genetischen und Umweltbedingungen konnten die Forschenden auch eine Reihe von Tumorverhaltensweisen in den Minikolons replizieren und beobachten und sogar Schlüsselfaktoren identifizieren, die das Fortschreiten von Krebs beeinflussen – zum Beispiel das Protein GPX2, das mit Stammzelleigenschaften und Tumorwachstum in Verbindung gebracht wird.
Diese bahnbrechende Forschung bietet ein wirksames neues Instrument zur Erforschung der zugrunde liegenden Mechanismen von Darmkrebs und zur Erprobung potenzieller Therapien, insbesondere wenn sie auf Gewebe von menschlichen Patienten angewendet wird. Die Fähigkeit der Minikolons, die Tumordynamik nachzuahmen, verringert unsere Abhängigkeit von Tiermodellen, was die Entdeckung und Entwicklung wirksamer Behandlungen beschleunigen kann.